Il y a deux mois j'ai emmené mon fils de 12 ans (Anthony) au palais de la découverte. Je trouve cet endroit magique et je vous le recommande vivement d'ailleurs. Vers la fin de la visite nous nous sommes attardés sur une exposition traitant de la formation des cristaux. C'est fascinant. Voyant qu'Anthony semblait autant émerveillé que moi, nous nous sommes mis au défi d'en "fabriquer" nous même ! Dans la voiture en rentrant j'ai commencé à lui donner quelques notions de base sur ce domaine de la chimie que l'on appelle la cristallographie :
En chimie, on entend par cristal, un empilement régulier d'un très grand nombre d'entités chimiques. S'il y a suffisamment d'entités microscopiques empilées, alors l'ensemble peut être visible à l' il nu ! Ces entités peuvent être des ions, des atomes ou des molécules.
Par exemple, le diamant est un empilement régulier d'atomes de carbone, mais ce genre de cristal est très difficile à réaliser. En effet, il faut presser tellement fort les atomes de carbone pour qu'ils se rangent de la façon qui correspond au diamant, que dans la nature, seul le poids des montagnes est capable d'en produire ; c'est pour cela que les mines de diamant se trouvent en général sous des montagnes.
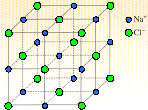
Dans le cas du sel de cuisine il s'agit d'un empilement régulier d'ions chlorures Cl- et d'ions sodium Na+. En général les cristaux formés d'ions sont plus faciles à faire que les autres, car les ions négatifs et les ions positifs s'attirent électrostatiquement. Pour imaginer la disposition des ions dans ce cristal, imaginez une "cage à écureuil" (vous savez, ces jeux d'enfants formés de barreaux tous parallèles ou orthogonaux entre eux ). Et bien imaginez qu'à chaque intersection des barreaux on place alternativement un Cl- ou un Na+.
Vous l'aurez compris, les barreaux n'existent pas mais aident à voir la disposition des ions dans l'espace.
Si maintenant on place un morceau de sel dans de l'eau, les molécules d'eau cassent le cristal et dispersent les ions en les entourant, c'est la dissolution ! Mais attention, on ne peut pas dissoudre autant de sel que l'on veut dans un volume d'eau donné. Si on veut trop en mettre il y a saturation (du sel reste solide au fond de l'eau).
Pour former un cristal il suffit de faire l'opération inverse de la dissolution, cela s'appelle la recristallisation. En effet, vous comprendrez qu'en partant d'une solution presque saturée en sel, si on laisse de l'eau s'évaporer, alors à un moment il y aura trop de sel dissout par rapport à l'eau restante. Du coup les ions commencent à se rassembler, un Cl- se rapproche d'un Na+ qui attire à son tour un autres Cl- et ainsi de suite. Les ions au départ dispersés viennent donc, un par un, prendre leur place et contribuent ainsi à faire grossir le cristal en formation.
Et voila : quand tout le solvant est évaporé il reste un ou plusieurs cristaux au fond du récipient !
Et attendez, je ne vous ai pas encore tout dit, le plus étonnant c'est que la forme des cristaux reproduit exactement la disposition des ions à l'échelle microscopique. Ainsi, selon la façon dont les ions s'empilent, le cristal a une forme ou une autre. On en trouve des hexagonales, des cubiques, d'autres sont en forme d'aiguilles
A ce stade de la discussion avec Anthony nous étions arrivés à la maison. Et nous avons voulu mettre en application cette belle théorie. Nous avons choisi de faire des cristaux de mono phosphate d'ammonium, car la forme est assez belle. On a donc dissout des petits grains de ce solide dans un récipient jusqu à saturation. Puis nous avons filtré pour éliminer l'excès de solide. Nous avons rajouté un peu de colorant vert alimentaire (pour les gâteaux) afin de colorer notre cristal. Dans cette solution saturée colorée nous avons ensuite placé un petit grain (suspendu à un fil) afin que le cristal se forme autour de cette amorce. Ensuite nous avons placé l'ensemble dans un endroit où la température varie peu car une variation thermique peut entraîner une malformation. Enfin nous avons attendu patiemment, et au bout de quelques jours voila ce que nous avons obtenu :

Vous avez bien suivi ? Alors, sauriez vous dire à quoi ressembleraient les cristaux si on avait utilisé du sel de cuisine à la place du mono phosphate d'ammonium ? Normalement oui, tout est dans le texte plus haut Si malgré une relecture vous n'avez pas la réponse, je crois que vous n'avez plus le choix : vous allez devoir tenter d'élever à votre tour des cristaux de Chlorure de sodium. Ainsi vous aurez la réponse sous les yeux Essayez, vous ne serez pas déçu !














